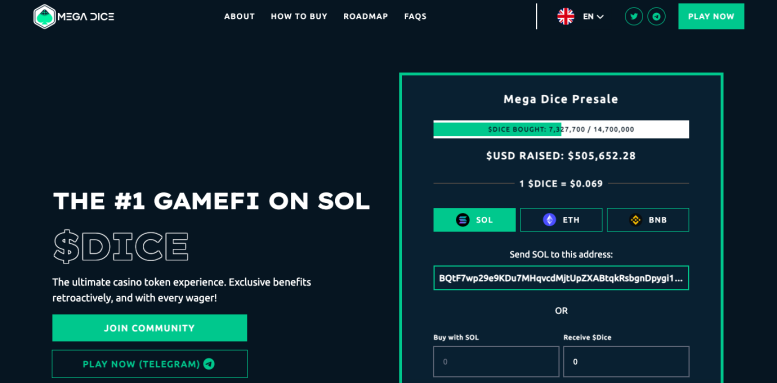
Actu Crypto et Finance
À la Une
Pourquoi Base va attirer les investisseurs crypto de demain ?
Selon Kelly Ye, la blockchain de couche 2 Base pourrait attirer la nouvelle génération d’utilisateurs crypto. Base, un élément important pour le futur de l’industrie ? Bitcoin adoption is happening as slowly as the Internet pic.twitter.com/WXW0pYpDu6 — Daniel Batten (@DSBatten) April 24, 2024 Selon Kelly Ye, de Decentral Park Capital, la blockchain de couche 2...
Une baleine révèle ses secrets pour devenir riche grâce aux données on-chain
La baleine Blurr.eth révèle comment appréhender les données et outils on-chain pour pouvoir vivre de la crypto. Des jeux de stratégies #ReFund #DeFi $RFD #ETH #RFD pic.twitter.com/u2TiEBJuDp — ReFund (@ReFundCoinETH) March 7, 2024 Selon Blur.eth, fondateur de ReFundCoinETH, l’exploration on-chain est comme un jeu de PvP, un véritable jeu de stratégie. En effet, que ce...