Actu Crypto et Finance
À la Une
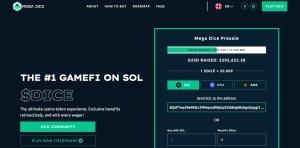
DICE : la nouvelle crypto GambleFi de Solana récolte déjà 500 000 $ en une semaine
Jeudi 25 avril 2024 – Lancée mercredi dernier, la prévente de Mega Dice (DICE), une nouvelle crypto du réseau Solana axée sur la GambleFi, a réussi à récolter plus de 500 000 $ en une semaine d’après les informations sur son site web. Mega Dice est un nom bien connu du secteur de la GambleFi. Il a été...
Pourquoi Base va attirer les investisseurs crypto de demain ?
Selon Kelly Ye, la blockchain de couche 2 Base pourrait attirer la nouvelle génération d’utilisateurs crypto. Base, un élément important pour le futur de l’industrie ? Bitcoin adoption is happening as slowly as the Internet pic.twitter.com/WXW0pYpDu6 — Daniel Batten (@DSBatten) April 24, 2024 Selon Kelly Ye, de Decentral Park Capital, la blockchain de couche 2...